植物はいったん根付くと、そこから動かずに生きていかなくてはいけない。乾燥や低温などにさらされたときは、その環境で必要となる遺伝子を発現させて生き延びる。植物のゲノムに含まれる数千ある遺伝子の中から、どのように必要な遺伝子を発現させるのだろうか。DNAとタンパク質の複合体であるクロマチンは、遺伝子の発現を制御する動的な構造体である。遺伝子が発現する時はクロマチンの構造が緩み、抑制される時はクロマチン構造は凝縮する。このクロマチンの弛緩と凝縮の構造変化は、環境変化とどのように連動しているのだろうか。松永幸大教授のグループは、遺伝子発現の場であるクロマチンが、環境変化が起こる前からスタンバイ状態で用意されており、環境変化に応じて変化することを見つけた。植物の環境応答におけるクロマチンのダイナミクスを調べる研究現場を訪ね、植物のクロマチン・ダイナミクス研究の魅力について聞いた。
教科書に採用された1枚の写真
みなさんはDNAの二重らせん構造を教科書で見たことがありますよね。でも実際は、DNAはあんなふうに露出していなくて、ヒストンというタンパク質複合体に巻きついたもの(ヌクレオソーム)が一定の間隔でつながり、さらに非常にコンパクトに凝集しています。そうしなければ、全長2 mにもなるヒトのDNAが、直径約5 µmの細胞核に収まるはずがありません。このDNAがコンパクトに収まった構造を、クロマチンと呼びます。でも、そんなにDNAが密集した状態では、転写因子やRNAポリメラーゼが近づくことができないので、遺伝子が発現するときにはクロマチンが緩んで、隙間ができた状態になるわけです。逆にクロマチンが凝集すると、遺伝子の発現が抑制されることになります。つい10年ほど前までは、クロマチンはヌクレオソームたちがきちんと規則正しく折りたたまれて直径30 nmの繊維状になっていると考えられていましたが、より進歩した顕微鏡技術やX線構造解析などの手法によって、意外にもランダムに凝集していることがわかってきています。クロマチンは、私たちが想像するよりもずっと融通の利く、動的な構造なのです。
中高時代は生物部
生物に興味を持った最初の記憶は幼稚園の年中の時です。好きな絵を描いてよいという時間に、アジサイやツバキなどの花を描き、周囲の友達から「女の子みたいだ!」と冷やかされ泣きそうになりました。でもその時、先生がその絵を見て「ひとつひとつよく見て描かれている!」とほめてくれたので嬉しかったです。小学校3年生の時に、両親に買ってもらった顕微鏡で藻類や花粉などを見て、ミクロの世界の虜になりました。中高では生物部で活動して、文化祭の特に「The Biology」というミニ論文集のような部誌を出版していましたね。結局、幼い時からから今まで、やっていることは変わらないのかもしれません。
大学院時代に染色体研究の世界へ
大学院5年間は、黒岩常祥先生のお世話になりました。黒岩先生は、オルガネラ研究の権威ですが、もとは染色体の研究者です。黒岩先生は、大学院時代に染色体を6本(2n = 6)しか持たないクレピスというタンポポの仲間の植物を研究されており、出芽酵母の染色体数が16本であることも世界で初めて決められています。私も、染色体のあの「くねくねした太いヒモの構造」が大好きなんです。顕微鏡で見て染色体像を見つけると、みんな個性があって違うじゃないですか、あれがいいんです。そこで、染色体研究ができる黒岩研に入りました。DNAとタンパク質の複合体であるクロマチンは、凝縮して染色体となった後に、再び核内に分散します。構造を作り、壊されて、また作られる。そのダイナミクスに心惹かれました。
静止画ではなくムービーが見たい
でも、当時の解析方法は細胞を固定してしまうため、映画でいうと、ある場面のワンショットしか見ていないのと同じだったのです。いつか、ダイナミックな変化をするクロマチンの研究を生きた細胞で研究したいと思いました。つまり細切れの静止画ではなく、通して映画を見たいということですね。
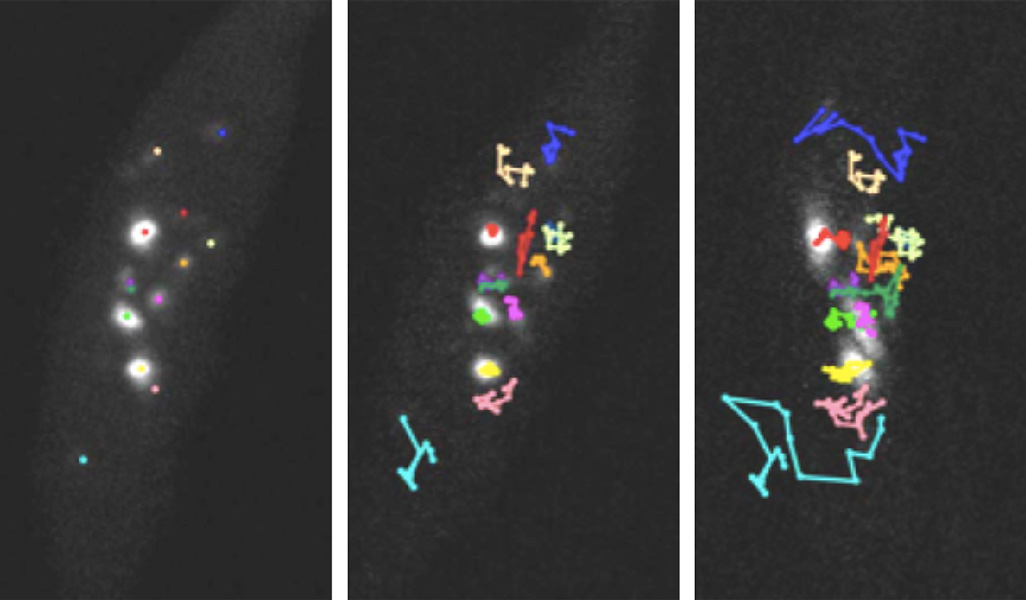
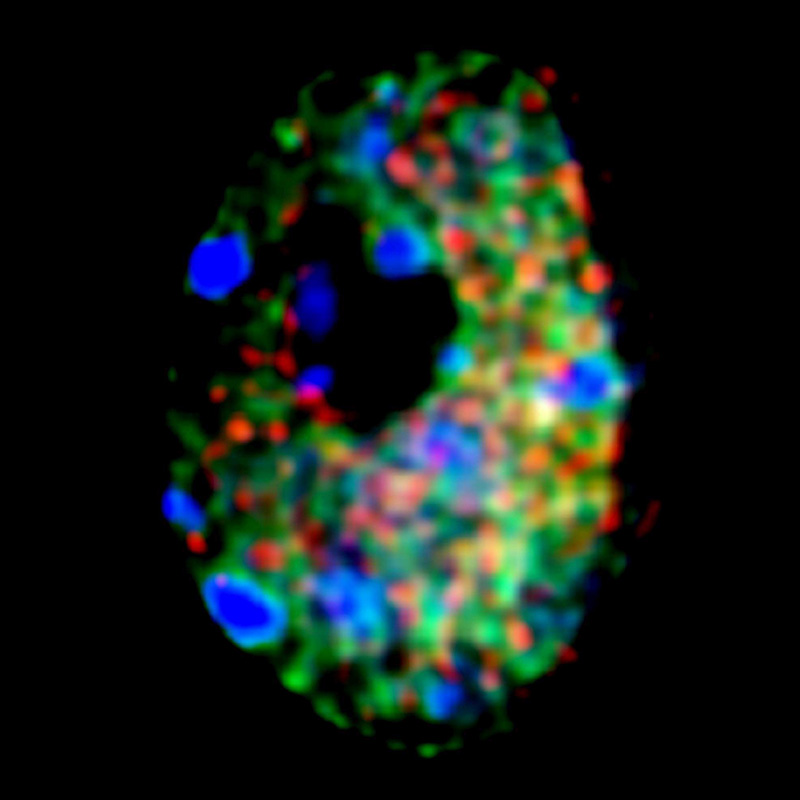
この頃、染色体の任意領域を可視化できるFISH (fluorescence in situ hybridization)という技術を身に付けました。「松永は趣味の釣りでも実験でも、FISHを相手にしている!」とよくからかわれました。FISHは今でもクロマチンや染色体研究に多用される手法ですが、やはり細胞を固定してしまうのです。私が博士号を取得したころ(1990年代後半)から、世の中では蛍光タンパク質が使われはじめ、生きた細胞の中で特定のタンパク質の動態を見る、ライブイメージングが勃興しました。ソフトの方は充実したのですが、顕微鏡のハード側はまだまだの状況で、顕微鏡ステージに温度と湿度を制御できるチャンバーをベンチャー会社と一緒に作製したりもしました。そのうち、寒天培地やガラスボトムディッシュなどを改良して、植物でも生きたまま蛍光イメージングできるようになったわけです。教え子の栗原大輔博士はさらにライブイメージング法を進化させて、最近では植物の胚発生や卵細胞の作られる様子まで観察しています。一方、クロマチンの可視化には、ゲノム編集に利用されていたDNA結合タンパク質を使用して、ようやく繰り返し配列を含んだ植物クロマチンがライブイメージングできるようになりました。昔、FISHで静止画しか見ることができなかった特定のクロマチン局在をムービーで見ることができるようになったときは、本当にうれしかったですね。
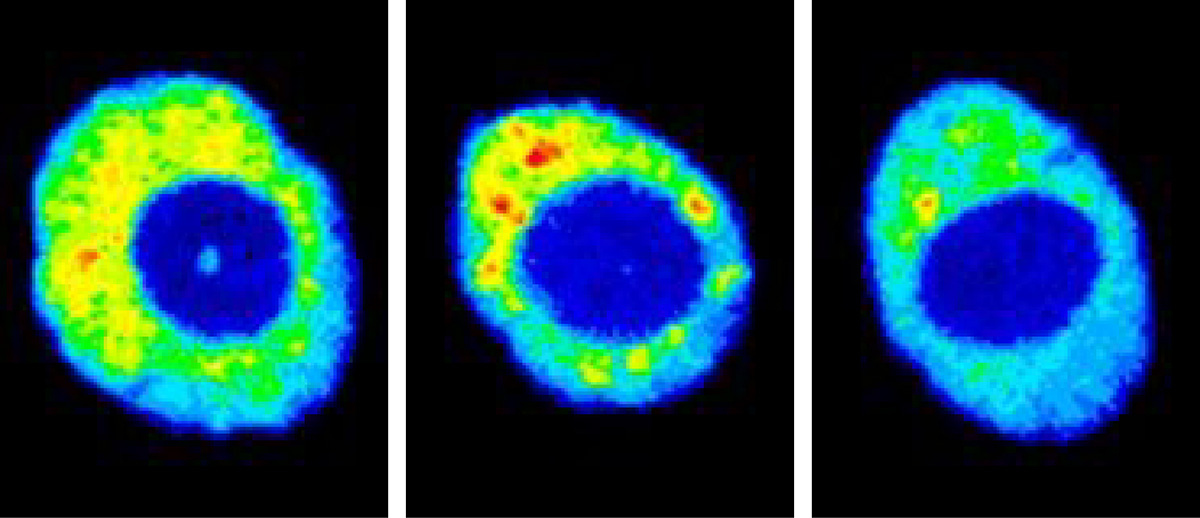
遺伝子発現を制御するクロマチン構造
最近では、さらにクロマチンの動態だけでなく、その構造変化を引き起こすヒストンのアミノ酸修飾に注目して研究を進めています。環境刺激に応じて、このヒストンの修飾が変化して、クロマチンの構造が変わり遺伝子発現が変化することがわかってきたのです。木村宏博士は、このクロマチン修飾の変化をとらえることができる抗体の一部を細胞内で作りだして、生きたまま細胞でクロマチン修飾を見ることに成功していました。そこで木村博士から、その抗体の一部の遺伝子をもらって、植物細胞でも作り出してみました。アイディアを話した仲間からは、植物は抗体をもっていないから、うまくいくわけない、と言われましたが、うまくいったんですね、これが。今では、生きた植物細胞で、ヒストンの修飾変化がわかるようになりました。今、環境刺激を与えて、どのようなヒストンの修飾変化が起こるか、ライブイメージングで調べようとしています。
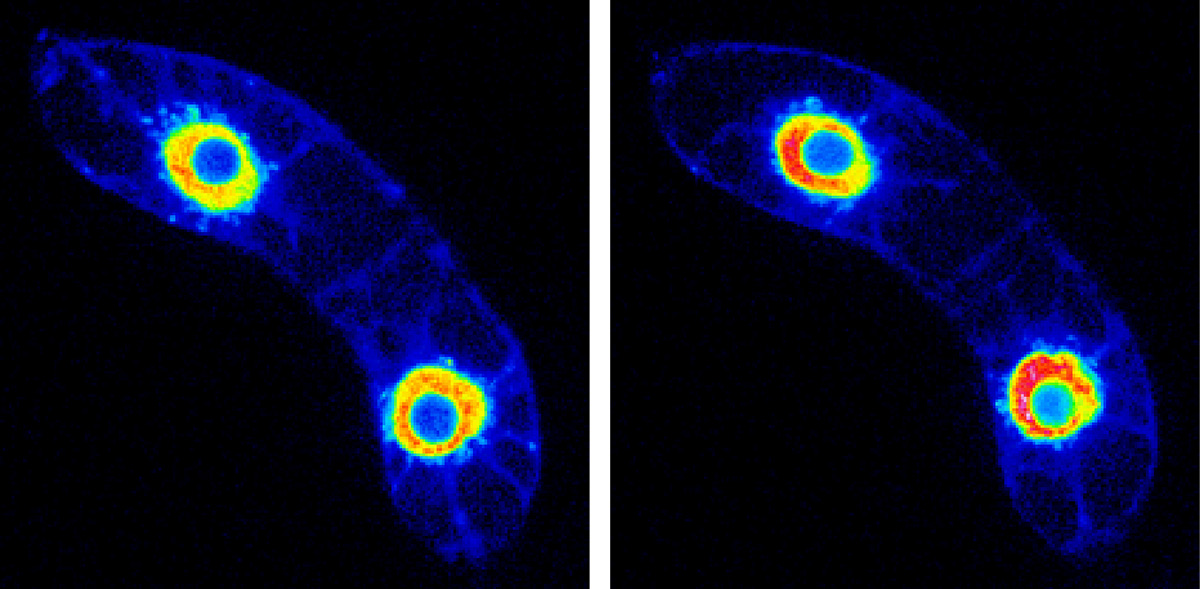
クロマチンを「生きた構造」としてとらえ直すと、次から次へと新発見がありました。例えば、温度変化、紫外線照射、土壌中の重金属によって植物のDNAに傷が入ります。放射線を植物に照射してDNAに傷を入れると、クロマチンの構造が変化することを見出しました。ある遺伝子は、環境中の銅イオンの濃度に合わせて細胞核内で真ん中に行ったり端に移動したりしながら、遺伝子発現のON/OFFのスイッチを切り替えていることがわかりました。さらに、植物で再生が起こる場合、あらかじめ再生に必要な遺伝子のクロマチンがスタンバイ状態になって準備していることも見つけました。脱分化した状態の植物は、ホルモンの刺激を受けると、地上部や地下部に分化します。この刺激が来る前から、将来、刺激が来た時に速やかに遺伝子発現がON/OFFになるように、クロマチンを緩めた状態にしていたのです。植物は動けない分、将来を予想して即座に遺伝子発現によって対応する態勢をつくっているんですね。備えあれば憂いなしということです。このように、静止物と捉えがちだったクロマチンを「動的な3次元構造」と捉えることでパラダイムシフトが起こったと感じています。
夢は3次元地図
今後は、環境刺激によってクロマチンがどのような空間的配置図をとるか、3次元アトラス(地図)を作成したいですね。2次元の塩基配列や因子の相互作用関係だけではわからなかったことが見えてくると思います。さらに、ライブイメージングを活用して、時間によってクロマチン同志が付いたり離れたりする4次元的な関係まで明らかにしたい。そうすれば、クロマチンのダイナミクスを通して、新しい植物の環境応答メカニズムが見えてくるのではないでしょうか。
細胞核は小宇宙だと思います。宇宙空間にはブラックホールもあれば、銀河系もあり、恒星や流星もあります。細胞核には、転写が活発な領域や抑制された領域などがいくつも形成されていて、個々の領域が3次元的に連携していると思います。植物は環境刺激が加わると細胞核内の領域連携の頻度が動物よりも活発化すると思っています。今からその仮説を検証することにワクワクしているところです。
新しい遺伝子操作技術へ
現在、植物の特定の遺伝子の発現を抑える方法は、遺伝子を壊したり改変したりするのが主流です。しかし、遺伝子の塩基配列を変えるのではなく、遺伝子の核内における3次元的な場所を移動させるだけで、遺伝子を抑制したり活性化させたりする技術が開発できると思います。新しい発想に基づいた遺伝子発現ON/OFF法です。そこで、現在は、クロマチンを動かすことで核内の遺伝子の場所を制御する因子の特定も進めています。自分の発見した現象や制御メカニズムが、新たな遺伝子操作技術の開発につながることを夢見ています。
構成協力 松永 朋子 / 撮影 松林 嘉克
松永 幸大 プロフィール:
1993年 東京大学理学部卒業。東京大学大学院理学系研究科にて博士(理学)の学位を取得。東京大学助手、大阪大学工学部准教授、東京理科大学理工学部教授を経て、2020年から現職。